Данная программа спонсируется компанией Медтроник и предназначена для обучения клиентов правильному разрешённому использованию продуктов компании Медтроник. В связи с этим, неразрешённое применение или показания не могут описываться или обсуждаться в рамках обучения.
Презентация не заменяет собой официальную инструкцию пользователя.
Прежде чем использовать продукцию, внимательно прочтите все инструкции, в том числе "Руководство по эксплуатации", прилагаемое к изделию. Обратите внимание на все предупреждения, предостережения и меры предосторожности, отмеченные в этих инструкциях. Невыполнение может привести к осложнениям для больного.
...
Заявление об ограничении ответственности
Система VenaSeal™ зарегистрирована на территории Российской Федерации как изделие медицинского назначения.
Пожалуйста, обратитесь к инструкции пользователя, чтобы ознакомиться с полным списком показаний, побочных эффектов, противопоказаний, предупреждений и полного описания процедуры.
ИСТОРИЧЕСКАЯ СПРАВКА О ТЕХНОЛОГИИ
• Хирургическое лигирование и стриппинг
• Амбулаторная флебэктомия
• Методы термической абляции
• ЭндоВенозная Лазерная Коагуляция (ЭВЛК)
• РадиоЧастотная Абляция (РЧА) - катетер ClosureFast™
• Склеротерапия
• Механическая Склеротерапия: система Clarivein™¹
• ЭндоВенозная Паровая Абляция (ЭВПА)²
¹Van den Bos et.al. Randomized clinical trial of endovenous laser ablation versus steam ablation (LAST) for great saphenous varicose veins. Br. J Surg 2014; 101:1077-1083 p.1077
² Нет данных о регистрации в РФ
ВОЗМОЖНЫЕ НЕДОСТАТКИ МЕТОДОВ
|
• Хирургия • Ручное удаление сегментов вены из ноги • Может требоваться общая анестезия • Шрамы от длинных разрезов • Продолжительный дискомфорт и уход за ранами после вмешательства • 2-3 недели на выздоровление • Ношение компрессионного трикотажа |
• Лазерная коагуляция¹ • Гиперпигментация • Рубцевание • Гематомы • Тромбофлебиты • Поражение нерва • Ношение компрессионного трикотажа |
¹Zahn H. & Bush R. A review of the current management and treatment options for superficial venous insufficiency. World J Surg, 2014; 38:2580-2588 p.2584
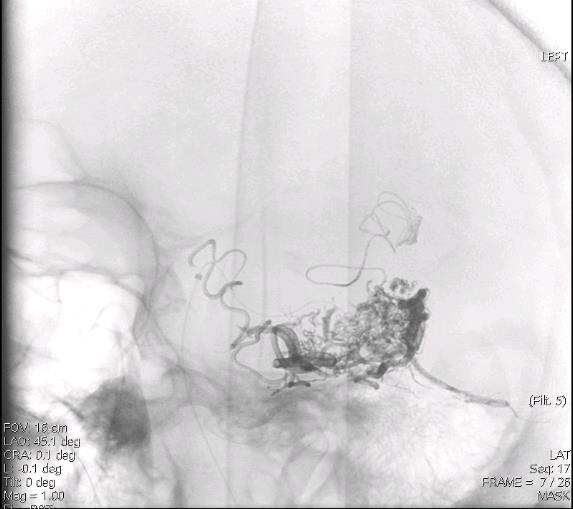 ✱
✱
КЛЕЙ УЖЕ ИСПОЛЬЗУЕТСЯ ДЛЯ ЛЕЧЕНИЯ АВМ
ДОСТАВКА ЧЕРЕЗ МИКРОКАТЕТЕР
✱С разрешения д-ра Raabe R.
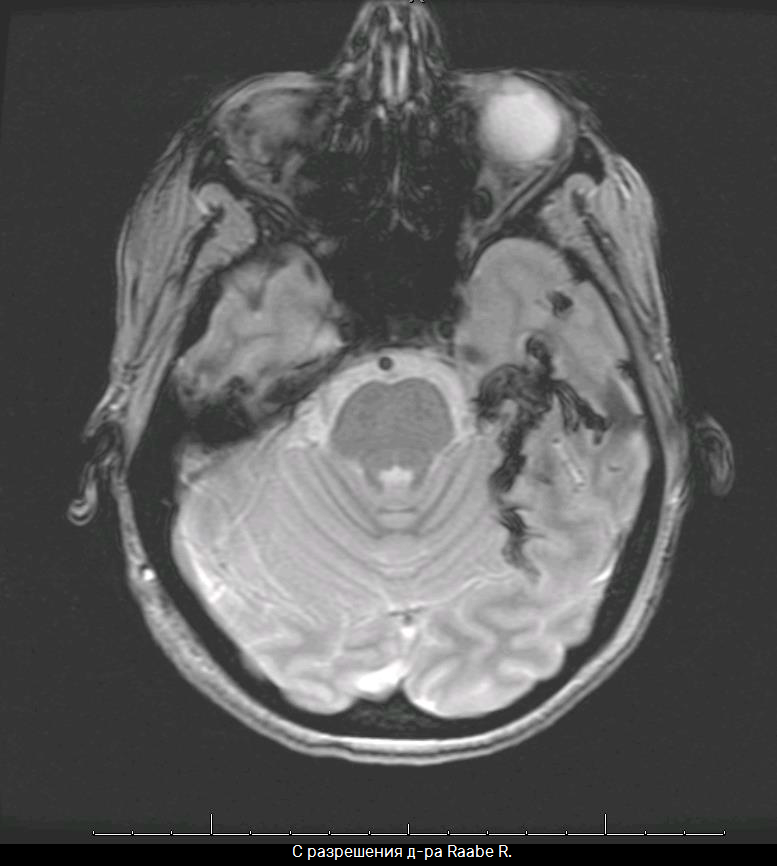
Большое количество клея / тромба
остаётся в АВМ, изображение МРТ
"Если мы можем склеить высокопоточные церебральные АВМ, почему бы не склеивать низкопоточные варикозные вены?"
Dr. Raabe R., 2008
АДГЕЗИВЫ В МЕДИЦИНСКОЙ ПРАКТИКЕ¹
Цианоакрилатный клей, разрешённый FDA (не мутагенный, не пирогенный, не гемолитический, не сенсибилизирующий, не вызывающий воспаление и не цитотоксичный)²
| Адгезив |
|
Дата | Регион | Использование | ||
|
Цианокрилатный адгезив (ЦА) |
1950s | Глобально | Склеивание ран | |||
|
Histoacryl Blue™✱ кожный клей |
1980s | ЕС/Канада | Разрезы кожи | |||
|
Dermabond™✱ кожный клей |
1998 | США |
Кожные разрезы / резаные раны |
|||
|
Ethicon OMNEX™✱ хирургический клей |
1998 | США |
Хирургический клей |
|||
|
Trufill™✱ жидкая эмболизирующая система |
2000 | США |
Жидкая эмболизирующая система, эмболизация АВМ |
|||
|
Indermil™✱ клей для тканей |
2002 | США |
Кожные разрезы / резаные раны |
¹ Pollak J., White R. The use of cyanoacrylate ashesives in peripheral embolization. J Vasc Interv Radiol, 2001; 12:907-913 p.908
² Lawson J. et.al. Sapheon: the solution? Phlebology, 2013; 28 Suppl 1:2-9 Review article p.3
ДРУГОЕ ПРИМЕНЕНИЕ МЕДИЦИНСКИХ ЦИАНОАКРИЛАТОВ¹
• Хирургия глаза
• Косметология
• Стоматология
• Сращение кожи
• Ортопедия
¹ Min et.al. Novel vein closure procedure using a proprietary cyanoacrylate adhesive: 30 day swine model results. Phlebology, 2012:1-6 p.1
ВНУТРИСОСУДИСТОЕ ИСПОЛЬЗОВАНИЕ
ОККЛЮЗИЯ
Состав для закрытия просвета сосудов при:
• Церебральной артериовенозной мальформации (АВМ)✱
• Синдроме тазового венозного полнокровия и варикоцеле✱
• Варикозном расширении вен желудка✱
• Аневризме аорты✱
✱ Min RJ et al. Vein closure using cyanoacrylate adhesive: 30 day swine model results. Phlebology, 2012:1-6 p.1-2
БЕЗОПАСНОСТЬ ЦИАНОАКРИЛАТНЫХ АДГЕЗИВОВ
• Широко используются для склеивания тканей1
• Антимикробное действие против грам-положительных бактерий2
• Безопасно используется у миллионов людей без сообщений о канцерогенезе (исследование 1986 года)2
¹ Lawson et al. Sapheon: the solution? Phlebology, 2013, 28 Suppl 1:2-9 p.3
² Quinn J., Tissue Adhesive in Clinical Medicine, 2nd ed. 2005 p. 34-35
ИДЕАЛЬНЫЙ КЛЕЙ ДЛЯ ВАРИКОЗНОЙ БОЛЕЗНИ ВЕН НИЖНИХ КОНЕЧНОСТЕЙ (ВБНК)
• Должен быть вязким: предотвращение миграции клея за пределы зоны лечения и обеспечивает хороший контакт с интимой стенки вены.
• Быстрая полимеризация: предотвращает эмболизацию за пределами зоны лечения.
• Должен быть мягким и эластичным: клей не должен чувствоваться после имплантации.
• Должен иметь прочное сцепление: предотвращает реканализацию.
• Снимает необходимость использования компрессионного белья после вмешательства.
ТЕХНОЛОГИЯ ИЗГОТОВЛЕНИЯ СИСТЕМЫ VENASEAL™
| Специально подобранный состав |
Вид полимеризованного клея под микроскопом |
|

|

|
ПРОЦЕСС ПОЛИМЕРИЗАЦИИ ЦИАНОАКРИЛАТА
Мономер цианоакрилата быстро полимеризуется при контакте с анионами плазмы крови.¹
¹ Almeida J. et al Cyanoacrylate adhesive for the closure of truncal veins: 60 day swine model results. Vasc and Endovasc Surg 000(00) 1-5. DOI 10.1177/1538574411413938 http://ves.sagepub.com
БИОСОВМЕСТИМОСТЬ КЛЕЯ VENASEAL™
• Клей VenaSeal™ был протестирован на биосовместимость в соответствии с ISO 10993-1 и FDA G95-1 Bluebook Memorandum.
• Результаты неопубликованного тестирования показали, что клей VenaSeal™ совместим с живыми тканями при использовании по показаниям.
ЦИАНОАКРИЛАТ В СОСУДЕ✱
• При контакте цианоакрилата (ЦА) с плазмой крови начинается полимеризация
• Организм инкапсулирует полимер как инородное тело
• ЦА запускает воспалительную реакцию в стенке сосуда, вызывая окклюзию
• Полимеризация повреждает интиму сосуда, запуская ответный каскад реакций на повреждение и фиброз
✱Almeida J. et.al. Cyanoacrylate adhesive for the closure of truncal veins: 60 day swine model results. Vasc and Endovasc Surg, 2001; 000(00) 1-5. DOI 10.1177/1538574411413938 http://ves.sagepub.com p.1
ИССЛЕДОВАНИЯ НА ЖИВОТНЫХ
ИЗМЕРЕНИЕ РАСПРОСТРАНЕНИЯ КЛЕЯ
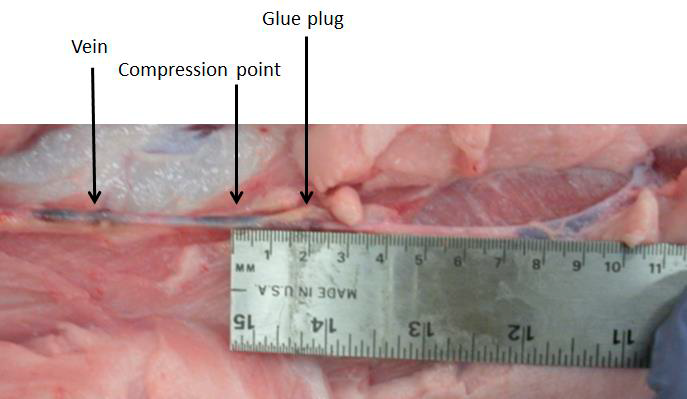
Система VenaSeal™ использовалась на трёх свиньях для определения, есть ли растекание клея и, если да, то, на сколько.
Заключение: Клей растекается на 1 - 2 см от места прижатия. Прижатие с помощью ультразвукового датчика обеспечивает широкую зону компрессии (шириной около 2 см), таким образом, клей растекется в пределах зоны прижатия. Попадание клея в другие вены или в лёгкие не выявлено. Клей формирует застывший барьер, который не продвигается за пределы зоны введения и прижатия датчиком.
КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
Клинические исследоания системы VenaSeal™
| Feasibility¹ |
• 38 пациентов, набор завершён в Августе 2011 • контрольные наблюдения через 1, 3, 6, 12, 24 и 36 месяцев • первичная конечная точка: безопасность и эффективность |
|
|
eSCOPE² (Европейское многоцентровое исследование) |
• 70 пациентов, набор завершён в Сентябре 2012 • контрольные наблюдения через 2 дня, 1, 3, 6, 12, 24 и 36 месяцев • первичная конечная точка: закрытие просвета без седации, тумесценции и компрессионного трикотажа |
|
|
VeClose³ (опорное исследование США) |
• 242 пациента, набор завершён в Сентябре 2013 • контрольные наблюдения через 3 дня, 1, 3, 6, 12 месяцев и 2, 3 года • первичная конечная точка: частота закрытия просвета БПВ не ниже, чем у РЧА • вторичная конечная точка: превосходит по отсутствию послеоперационной болезненности и синяков |
¹ Medtronic. (2014). Sapheon™ Closure System Feasibility Study Print Date Final Clinical Study Report, CR-10669-03 (Rev A). Morrisville, NC: Giovino, K.
² Proebstle, T. eSCOPEthree year data. Charing Cross 2016.
³ Kolluri, R. VeClose two-year data. Charing Cross 2016.
ИССЛЕДОВАНИЕ FEASIBILITY
Цель
• Оценить безопасность, эффективность и фактические результаты использования системы Sapheon™ при лечении несостоятельных подкожных вен.
Дизайн исследования
• Одноцентровое, проспективное, нерандомизированное, первое на людях.
Субъекты исследования
• Набрано 38 пациентов.
Первичные конечные точки
• Безопасность: частота опасных побочных эффектов.
• Эффективность: успех лечения определялся как полная окклюзия пролеченного сегмента вены по данным дуплексного ультразвукового исследования.
Вторичные конечные точки
• Частота всех побочных эффектов.
• Изменение по венозной клинической шкале тяжести (VCSS).
¹ Medtronic. (2014). Sapheon™Closure System Feasibility Study Print Date Final Clinical Study Report, CR-10669-03 (Rev A). Morrisville, NC: Giovino, K.
Результаты
ОСНОВНЫЕ ХАРАКТЕРИСТИКИ И ДАННЫЕ О ПРОЦЕДУРЕ
| N = 38 | Среднее | |
| Возраст (лет) | 51 (разброс 26 - 27) | |
| Пол | 76 % Жен - 24% Муж | |
| ИМТ | 27.6 (разброс 22.4 - 45.3) | |
| Длина сегмента лечения (см) | 33.8 + 9.1 ст. откл. | |
| Диаметр целевой вены (мм) | 8 + 2.2 ст. откл. | |
| Время процедуры (мин) | 21 (разброс 14 - 33) | |
| Общий объём введённого ЦА (мл) | 1.3 (разброс 0.6 - 2.3) |
¹Medtronic. (2014). Sapheon™Closure System Feasibility Study Print Date Final Clinical Study Report, CR-10669-03 (Rev A). Morrisville, NC: Giovino, K.
ЧАСТОТА ЗАКРЫТИЯ ВЕН
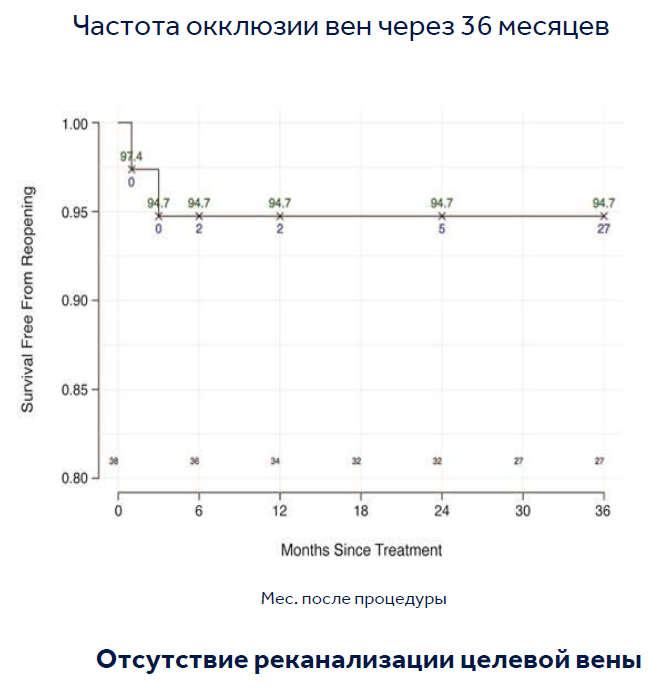
| Контрольный период | Частота окклюзии | |
| 12 месяцев¹ | 94.7 % | |
| 24 месяца¹ | 94.7 % | |
| 36 месяцев¹ | 94.7 % |
¹ Medtronc. 2014. Sapheon™ Closure System Feasibility Study Print Date Final Clinical Study Report, CR-10669-03 (Rev A). Morrisville, NC: Giovino, K.
УЛУЧШЕНИЯ ПО ШКАЛЕ VCSS НА ПРОТЯЖЕНИИ 36 МЕСЯЦЕВ
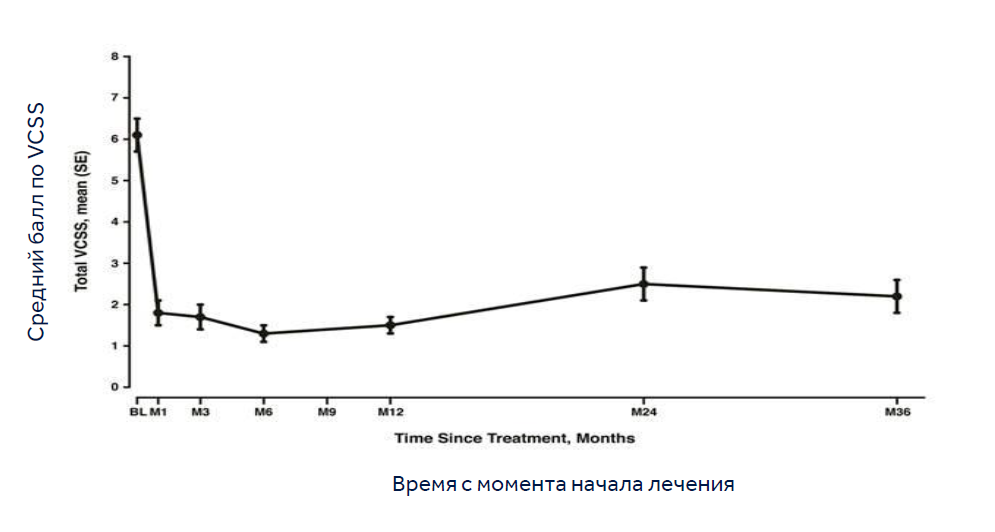
ВЫВОДЫ ИССЛЕДОВАНИЯ FEASIBILITY¹
• Не использовался компрессионный трикотаж после процедуры, местная анестезия проводилась только в месте входа в вену.
• Продолжительность процедуры была короткой, а периоперационные побочные эффекты были умеренными и краткосрочными.
• Использование системы VenaSeal™ на людях для закрытия несостоятельной большой подкожной вены практически осуществимо, безопасно и эффективно.
¹ Medtronc. 2014. Sapheon™ Closure System Feasibility Study Print Date Final Clinical Study Report, CR-10669-03 (Rev A). Morrisville, NC: Giovino, K.
eSCOPE
ЕВРОПЕЙСКОЕ МНОГОЦЕНТРОВОЕ ИССЛЕДОВАНИЕ¹
Цель
• Оценить безопасность и эффективность применения системы Sapheon™ для лечения рефлюкса по большой подкожной вене.
Дизайн исследования
• Проспективное, многоцентровое, нерандомизированное исследование.
Субъекты исследования
• Набрано 70 пациентов, N=70 пролеченных БПВ.
Первичные конечные точки
• Оценка закрытия вены на дуплексном сканироваании через 6 месяцев без использования седации, тумесцентной анестезии и компрессионного белья.
Контрольные обследования
• 48 часов, 1, 3, 6, 12, 24 и 36 месяцев.
¹ Proebstle, T. eSCOPE three year data. Charing Cross, 2016.
КЛЮЧЕВЫЕ КРИТЕРИИ ОТБОРА ПАЦИЕНТОВ¹
Критерии включения
• Симптоматическая первичная несостоятельность БПВ, установленная по клиническим признакам с или без видимого варикоза и подтверждённая на дуплексном ультразвуковом сканировании.
• Классы по СЕАР: С2, С3 или С4.
• Диаметр БПВ в положении стоя на предоперационном УЗИ ≥3 мм и ≤10 мм (максимальный диаметр).
• Способность понять требования исследования и подписанное информированное согласие.
Критерии исключения
• Предыдущие эпизоды лечения вен на целевой конечности.
• Установленная гиперчувствительность к цианоакрилатному клею.
• Состояния, препятствующие плановому лечению вен, такие как: острое заболевание, неподвижность или неспособность передвигаться, беременность.
• Извитость БПВ, препятствующая проведению процедуры по оценке исследователя (две и более точки входа в вену не разрешены).
• Несостоятельность ипсилатеральной МПВ или переднего притока БПВ.
¹ Proebstle, T. eSCOPE three year data. Charing Cross, 2016.
ИССЛЕДОВАНИЕ eSCOPE - РЕЗУЛЬТАТЫ
ОСНОВНЫЕ ХАРАКТЕРИСТИКИ И ДАННЫЕ О ПРОЦЕДУРЕ¹
| N = 70 | Среднее | |
| Возраст (лет) | 48.4 (разброс 22 - 72) | |
| Пол | 78.6 % женщин | |
| ИМТ | 25.6 (разброс 18.9 - 43.4) | |
| Длина сегмента лечения (см) | 37.6 (разброс 7-72) | |
| Диаметр целевой вены (мм) | 7.8 ± 2.1 станд.отклон. | |
|
Среднее время процедуры (мин) (Время от момента введения катетера до момента извлечения) |
18.6 (разброс 8 - 74) |
¹ Proebstle, T. eSCOPE three year data. Charing Cross, 2016.
РЕЗУЛЬТАТЫ
| Контрольный период | Число реканализаций / Количество пациентов |
Частота окклюзии | ||
| Процедура | 1/70 | 98.6 % (95.8 - 100.0 %) | ||
| 24 - 72 hr | 2/69 | 95.7 % (91.1 - 100.0 %) | ||
| 30-Day | 0/67 | 95.7 % (91.1 - 100.0 %) | ||
| Month 3 | 2/67 | 92.9 % (87.0 - 99.1 %) | ||
| Month 6 | 1/65 | 91.4 % (85.1 - 98.2 %) | ||
| Month 12 | 1/64 | 90.0 % (83.2 - 97.3 %) | ||
| Month 24 | 1/60 | 88.5 % (81.3 - 96.3 %) | ||
| Month 36 | 0/56 | 88.5 % (81.3 - 96.3 %) |
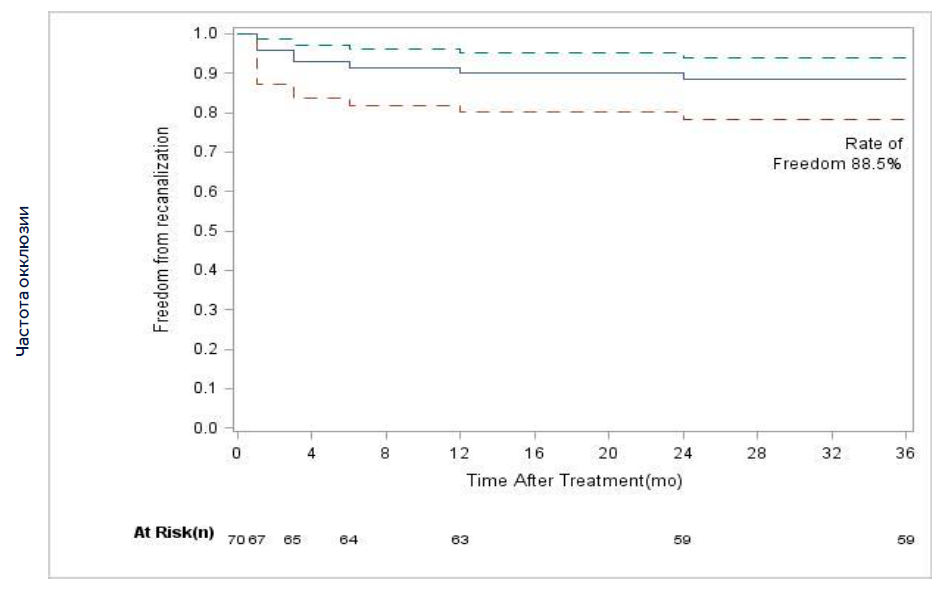
¹ Proebstle, T. eSCOPE three year data. Charing Cross, 2016.
ВЫВОДЫ
• Частота закрытия 92.9 % через 12 месяцев, 88.5 % через 24 месяца, 88.5 % через 36 месяцев.¹
• Не использовались тумесцентная анестезия, компрессионный трикотаж.
¹ Proebstle, T. eSCOPE three year data. Charing Cross, 2016.
eSCOPE исследование продолжается
VeClose¹,²
ОПОРНОЕ ИССЛЕДОВАНИЕ ДЛЯ РЕГИСТРАЦИИ В США
Цель
• Доказать, что безопасность и эффективность использования системы VenaSeal™ для лечения стволового рефлюкса по венам нижних конечностей не ниже, чем у РЧА Covidien ClosureFast™ в период налюдения - 3 месяца.
Дизайн
• Опорное, проспективное, рандомизированное 1:1 сравнительное исследование системы VenaSeal™ (VS) и РЧА (ClosureFast™).
Субъекты исследования
• 242 пациента набрано
• 108 VS, 114 РЧА = рандомизированная группа
• Контроль через 3, 30 дней, 3, 6, 12, 24 и 36 месяцев
Первичная конечная точка черз 3 месяца
• Закрытие БПВ определялось дупрелксным ультразвуковым сканированием, не меньшая эффективность VenaSeal™ по сравнению с РЧА оценивалась при помощи дуплексного ультразвукового сканирования и обеспечивалась независимой сосудистой ультразвуковой лабораторией
Вторичная конечная точка
• Интраоперационная боль, оцениваемая по цифровой шкале от 0 до 10
• Синяки на 3й день, ранжированные по шкале от 0 до 5
• Побочные эффекты через 1 месяц
Без применения вспомогательной терапии за 3 месяца до проведения процедуры
¹ Morrison, N., Randomized trial comparing cyanoacrylate embolization and radiofrequency ablation for incompetent great saphenous veins (VeClose) 3 Month Results. JVS, 2015 Apr. 61(4):985-94.
² Kolluri, R. VeClose two-year data. Charing Cross 2016.
ДЕМОГРАФИЧЕСКИЕ И ОСНОВНЫЕ ХАРАКТЕРИСТИКИ
Статистических различий в демографических |
|||
| Характеристики | Цианоакрилат (N = 108) |
РЧА (N = 114) | Roll-in группа✱ (N = 20) |
| Женщины, число (%) | 83 (77) | 93 (82) | 17 (85) |
| Темнокожие, число (%) | 6 (6) | 8 (7) | 1 (5) |
| Возвраст, средний (диапазон) |
49.0 (27-71) | 51 (26-70) | 53.1 (36-65) |
| ИМТ, средний (диапазон) |
27.0 (17.4-44.5) | 27.0 (17.0-46.7) | 27.9 (17.8-37.8) |
Mid GSV diameter, mm (range) |
|||
| Средняя БПВ | 4.9 (1.7-9) | 5.1 (2.4-11) | 5.3 (3-8.4) |
| Прохимальная БПВ | 6.3 (3-12) | 6.6 (2.8-12) | 6.9 (4.6-10) |
CEAP классификация, n (%) |
|||
| C2 | 61 (57) | 64 (56) | 12 (60) |
| C3 | 32 (30) | 36 (32) | 7 (35) |
| C4a | 13 (12) | 12 (11) | 1 (5) |
| C4b | 2 (2) | 2 (2) | 0 (0) |
Baseline Scores |
|||
| VCSS, средний (SD) | 5.5 (2.6) | 5.6 (2.6) | 5.5 (2.9) |
| AVVQ, средний (SD) | 18.9 (9.0) | 19.4 (9.9) | 17.0 (7.5) |
| EQ-5D TTO, средний (SD) |
0.935 (0.113) | 0.918 (0.116) | 0.895 (0.104) |
✱Пациенты, которых пролечили при помощи цианоакрилатного клея, доктора впервые выполняли данную процедуру.
ХАРАКТЕРИСТИКИ ПРОЦЕДУРЫ
| Характеристики процедуры |
Цианоакрилатный клей (N=108) |
РЧА (N=114) | Roll-in группа (N=20) |
Вероятность отклонения в группах Цианоакрилат / Roll-in |
| Средняя продолжительность в минутах (диапазон) |
24 (11-40) | 19 (5-46) | 31 (23-46) | <0.0001 |
| Максимальный диаметр пролеченной вены в мм (диапазон) |
5.9 (2-12) | 6.2 (1.5-11) | 6.4 (3.4-11.2) | 0.29 |
| Длина культи в мм (диапазон) |
5.9 (2-12) | 6.2 (1.5-11) | 6.4 (3.4-11.2) | 0.29 |
